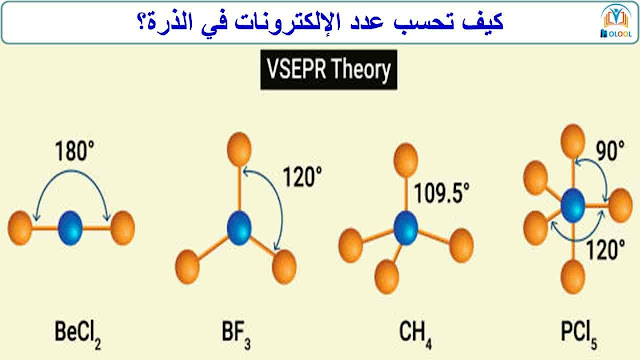
قاعدة حساب عدد الإلكترونات
مقدمة
يعد حساب عدد الإلكترونات مفهومًا أساسيًا في الكيمياء والفيزياء ، حيث تلعب الإلكترونات دورًا مهمًا في سلوك الذرات والجزيئات والمواد. عدد الإلكترونات في الذرة أو الجزيء ضروري لتحديد هيكلها الإلكتروني ، والذي بدوره يملي خصائصه الكيميائية والفيزيائية. في هذا المقال سنناقش قاعدة حساب عدد الإلكترونات وأهميتها في الكيمياء والفيزياء.
ما هي قاعدة حساب عدد الإلكترونات
قاعدة حساب عدد الإلكترونات واضحة ومباشرة. عدد الإلكترونات في الذرة يساوي عددها الذري ، وهو عدد البروتونات في نواتها. على سبيل المثال ، العدد الذري للكربون هو 6 ، مما يعني أنه يحتوي على ستة إلكترونات. تنطبق هذه القاعدة على جميع العناصر ، وتسمح للعلماء بالتنبؤ بالبنية الإلكترونية للذرة بسرعة.
عند التعامل مع الأيونات ، يختلف عدد الإلكترونات عن العدد الذري. الأيون هو ذرة اكتسبت أو فقدت إلكترونًا واحدًا أو أكثر ، مما يعطيها شحنة موجبة أو سالبة. في الكاتيون ، عدد الإلكترونات يساوي العدد الذري مطروحًا منه عدد الإلكترونات المفقودة. على سبيل المثال ، يحتوي أيون الصوديوم (Na +) على 11 بروتونًا و 10 إلكترونات ، مما يمنحه شحنة +1. في الأنيون ، عدد الإلكترونات يساوي العدد الذري بالإضافة إلى عدد الإلكترونات المكتسبة. على سبيل المثال ، يحتوي أيون الكلوريد (Cl-) على 17 بروتونًا و 18 إلكترونًا ، مما يمنحه شحنة -1.
أهمية حساب عدد الإلكترونات
عدد الإلكترونات عامل حاسم في تحديد الخواص الكيميائية والفيزيائية للذرات والجزيئات. تحدد البنية الإلكترونية للذرة تفاعلها وسلوك الترابط وخصائصها الطيفية. على سبيل المثال ، يحتوي الكربون على أربعة إلكترونات تكافؤ ، مما يسمح له بتكوين أربعة روابط تساهمية مع ذرات أخرى. يحتوي الأكسجين على ستة إلكترونات تكافؤ ، مما يسمح له بتكوين رابطتين تساهمية وزوجين منفصلين من الإلكترونات. تحدد البنية الإلكترونية أيضًا طاقة التأين وتقارب الإلكترون في الذرة ، وهي عوامل مهمة في التفاعلات الكيميائية.
في علم المواد ، يعتبر الهيكل الإلكتروني أمرًا بالغ الأهمية في تحديد الخصائص الكهربائية والضوئية والمغناطيسية للمواد. في أشباه الموصلات ، يحدد عدد الإلكترونات في نطاق التوصيل ونطاق التكافؤ الموصلية الكهربائية وخصائص الامتصاص البصري. في المواد المغناطيسية ، يحدد عدد الإلكترونات غير المزدوجة الخصائص المغناطيسية.
كيف تحسب عدد الإلكترونات في الذرة؟
لحساب عدد الإلكترونات في الذرة ، تحتاج إلى معرفة العدد الذري للعنصر. يمثل العدد الذري عدد البروتونات في نواة الذرة ، وبما أن الذرات متعادلة كهربائيًا ، يجب أيضًا أن يكون عدد الإلكترونات في الذرة مساويًا لعدد البروتونات. لذلك ، فإن عدد الإلكترونات في الذرة يساوي عددها الذري.
على سبيل المثال ، العدد الذري للكربون هو 6 ، مما يعني أنه يحتوي على ستة إلكترونات. العدد الذري للنيتروجين هو 7 ، مما يعني أنه يحتوي على سبعة إلكترونات ، وهكذا لجميع العناصر في الجدول الدوري.
من المهم ملاحظة أنه في حالة الأيون ، يمكن أن يختلف عدد الإلكترونات عن العدد الذري. الأيون هو ذرة اكتسبت أو فقدت إلكترونًا واحدًا أو أكثر ، مما يعطيها شحنة موجبة أو سالبة. في الكاتيون ، عدد الإلكترونات يساوي العدد الذري مطروحًا منه عدد الإلكترونات المفقودة. في الأنيون ، عدد الإلكترونات يساوي العدد الذري بالإضافة إلى عدد الإلكترونات المكتسبة.
على سبيل المثال ، يحتوي أيون الصوديوم (Na +) على 11 بروتونًا و 10 إلكترونات ، مما يمنحه شحنة +1. العدد الذري للصوديوم هو 11 ، مما يعني أنه يحتوي عادةً على 11 إلكترونًا ، ولكن في حالة أيون الصوديوم ، فقد إلكترون واحد. وبالمثل ، يحتوي أيون الكلوريد (Cl-) على 17 بروتونًا و 18 إلكترونًا ، مما يمنحه شحنة -1. العدد الذري للكلور هو 17 ، مما يعني أنه يحتوي عادة على 17 إلكترونًا ، ولكن في حالة Cl- أيون ، تم اكتساب إلكترون واحد.
بعض الأمثلة على حساب عدد الإلكترونات في الذرات
الهيدروجين (H):
العدد الذري للهيدروجين هو 1 ، مما يعني أنه يحتوي على بروتون واحد وإلكترون واحد.
الكربون (ج):
العدد الذري للكربون هو 6 ، مما يعني أنه يحتوي على ستة بروتونات وستة إلكترونات.
الأكسجين (O):
العدد الذري للأكسجين هو 8 ، مما يعني أنه يحتوي على ثمانية بروتونات وثمانية إلكترونات.
الصوديوم (نا):
العدد الذري للصوديوم هو 11 ، مما يعني أنه يحتوي على 11 بروتونًا و 11 إلكترونًا في حالته المحايدة. ومع ذلك ، إذا فقد إلكترونًا واحدًا ، فإنه يصبح أيون صوديوم بشحنة +1 ، وسيكون به 11 بروتونًا و 10 إلكترونات.
الكلور (Cl):
العدد الذري للكلور هو 17 ، مما يعني أنه يحتوي على 17 بروتونًا و 17 إلكترونًا في حالته المحايدة. ومع ذلك ، إذا اكتسب إلكترونًا واحدًا ، فإنه يصبح أيون كلوريد بشحنة -1 ، وسيكون به 17 بروتونًا و 18 إلكترونًا.
الحديد (Fe):
العدد الذري للحديد هو 26 ، مما يعني أنه يحتوي على 26 بروتونًا و 26 إلكترونًا في حالته المحايدة.
عدد الإلكترونات في الذرة يساوي عددها الذري ، ويمكن استخدام هذه المعلومات للتنبؤ بالبنية الإلكترونية والتفاعلية وسلوك الترابط والخصائص الفيزيائية للذرات والجزيئات.
خاتمة
قاعدة حساب عدد الإلكترونات مفهوم أساسي في الكيمياء والفيزياء. يحدد عدد الإلكترونات البنية الإلكترونية للذرة ، والتي بدورها تحدد خصائصها الكيميائية والفيزيائية. يعتبر الهيكل الإلكتروني أمرًا بالغ الأهمية في التنبؤ بالتفاعلية وسلوك الترابط والخصائص الطيفية للذرات والجزيئات. في علم المواد ، تعتبر البنية الإلكترونية ضرورية في تحديد الخصائص الكهربائية والضوئية والمغناطيسية للمواد. قاعدة حساب عدد الإلكترونات هي أداة بسيطة لكنها قوية تسمح للعلماء بفهم سلوك المادة على المستوى الذري والجزيئي.
بعض الأسئلة المتداولة حول قاعدة حساب عدد الإلكترونات:
س: ما هو العدد
الذري؟
ج: العدد الذري
هو عدد البروتونات في نواة الذرة ، وهو فريد لكل عنصر. يمثله الرمز Z في الكيمياء.
س: ما العلاقة
بين العدد الذري وعدد الإلكترونات؟
ج: عدد
الإلكترونات في الذرة يساوي العدد الذري ، بافتراض أن الذرة محايدة. إذا كانت
الذرة عبارة عن أيون ، يمكن أن يختلف عدد الإلكترونات عن العدد الذري.
س: كيف تحدد
عدد الإلكترونات في أيون؟
ج: يمكن تحديد
عدد الإلكترونات في أيون عن طريق إضافة أو طرح عدد الإلكترونات من الذرة المحايدة
، اعتمادًا على ما إذا كان للأيون شحنة موجبة أو سالبة.
س: هل يمكن أن
يتغير عدد الإلكترونات في الذرة؟
ج: يمكن أن
يتغير عدد الإلكترونات في الذرة إذا اكتسبت الذرة أو فقدت إلكترونات لتصبح أيونًا
، أو إذا خضعت الذرة لتفاعل كيميائي يتضمن نقل أو مشاركة الإلكترونات مع ذرات
أخرى.
س: ما أهمية
معرفة عدد الإلكترونات في الذرة؟
ج: إن معرفة
عدد الإلكترونات في الذرة أمر مهم للتنبؤ بالبنية الإلكترونية والتفاعلية وسلوك
الترابط والخصائص الفيزيائية للذرات والجزيئات. كما أنه ضروري لفهم سلوك الذرات
والجزيئات في التفاعلات الكيميائية وتصميم مواد جديدة بخصائص محددة.
اقراء ايضا: الكيمياء العضوية: نظرة متعمقة على علم الجزيئات الكربونية